全程导医网 徐州健康信息:2025年诺贝尔生理学或医学奖授予了 Mary Brunkow、Fred Ramsdell、坂口志文。他们发现并定义了调节性 T 细胞(Treg 细胞),揭示了其在控制自身反应性响应中的重要性,开创了 Treg 细胞介导的外周免疫耐受这一新领域。然而,Treg 细胞适应恶劣的肿瘤代谢微环境从而抑制抗肿瘤免疫的机制,在很大程度上仍不清楚。
2025年12月24日,徐州医科大学附属医院吕凌教授团队联合南京医科大学第一附属医院在国际顶级期刊《Cell》正式发表“Tumor-produced ammonia is metabolized by regulatory T cells to further impede anti-tumor immunity”研究论文。该研究表明,肿瘤产生的氨会被调节性 T 细胞(Treg 细胞 )代谢,增强 Treg 细胞,从而进一步阻碍抗肿瘤免疫反应。该研究提示了将氨生成作为靶点能够抑制 Treg 细胞,从而为抗肿瘤免疫治疗提供了一种潜在新策略。这是徐州医科大学、徐州医科大学附属医院首次以第一完成单位在国际三大顶级学术杂志发表重大研究成果,实现了高水平论文重大突破。
首次描绘肿瘤内免疫抑制亚区域关键代谢特征
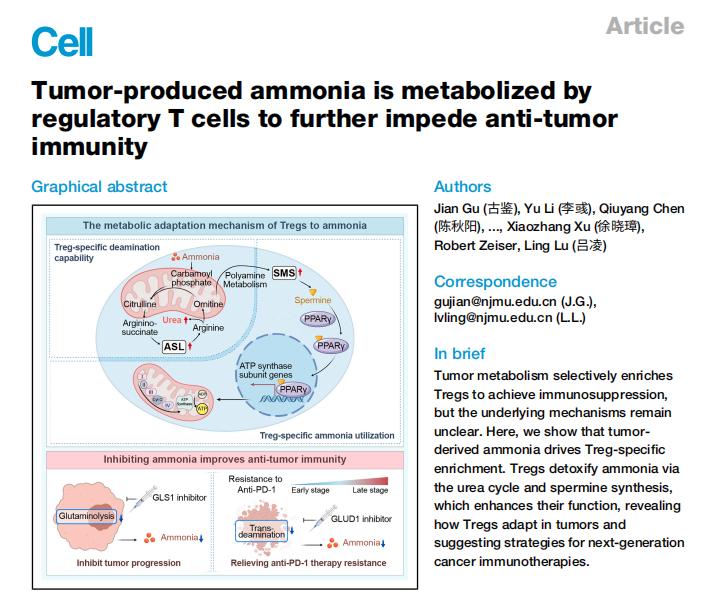
调节性T细胞是肿瘤微环境中最重要的免疫抑制细胞之一,在肿瘤进展和免疫治疗耐受中发挥核心作用。然而,在肿瘤内部代谢环境持续恶化、对免疫细胞高度不利的条件下,Tregs却能够长期存活并显著富集,其背后的代谢适应机制一直未被系统阐明。
研究团队聚焦肿瘤细胞高度活跃的谷氨酰胺代谢过程,发现该代谢途径会在肿瘤局部大量产生氨。通过空间转录组学与空间代谢组学联合分析,研究人员首次在组织空间尺度上证实:Tregs显著富集于氨高度积聚的肿瘤亚区,而效应性CD8+和CD4+T细胞在这些区域大量凋亡,提示氨是塑造免疫抑制性肿瘤微环境的重要代谢因子。
阐明Tregs适应氨环境的双重机制
进一步机制研究发现,Tregs通过两条高度特异的代谢通路适应氨富集环境,并将其转化为功能优势。一方面,Tregs可通过激活尿素循环关键酶ASL,有效降低细胞内氨水平,从而抵抗氨毒性并维持细胞存活。该过程依赖SRC3–STAT3信号轴的选择性激活,使Tregs具备其他T细胞亚群所不具备的“解毒”能力;另一方面,研究发现尿素循环中间代谢物被进一步引流至多胺代谢通路。在Tregs特异性转录因子FOXP3的调控下,精胺合成酶SMS被显著上调,生成的精胺可直接结合并激活PPARγ,系统性增强线粒体氧化磷酸化能力,从而显著提高Tregs的免疫抑制功能。研究团队通过结构生物学手段,在分子层面验证了这一直接相互作用。
揭示免疫治疗耐受的新代谢机制
研究还发现,抗PD-1治疗诱导的肿瘤细胞死亡可通过转氨反应进一步释放氨,反过来强化肿瘤局部Tregs的免疫抑制功能,促进免疫治疗耐受。在多种肿瘤模型中,靶向抑制氨生成关键代谢酶GLUD,可显著降低肿瘤内氨水平,削弱Tregs的免疫抑制作用,并明显增强免疫检查点抑制剂的治疗效果。
研究意义
该研究从代谢角度系统阐明了肿瘤免疫抑制的新机制,提出了“肿瘤来源氨—Tregs代谢适应—免疫逃逸”的全新理论模型,不仅深化了对肿瘤免疫微环境的认识,也为优化肿瘤免疫治疗策略、提高临床疗效提供了重要科学依据。
徐州导医热线:0516-85707122







